
WODA
Zwi▒zki chemiczne wystΩpuj▒ce w kom≤rce wykazuj▒ niezwyk│▒ z│o┐ono╢µ i r≤┐norodno╢µ. Wszystkie one jednak zbudowane s▒ z ograniczonej liczby podstawowych pierwiastk≤w. W najwiΩkszych ilo╢ciach wystΩpuj▒ tlen, azot, wΩgiel i wod≤r û stanowi▒ one ok. 99% masy kom≤rki.
Najliczniej wystΩpuj▒c▒ w ┐ywej kom≤rce substancj▒ jest woda û stanowi ona ok. 70% masy kom≤rki. Pe│ni ona podstawow▒ rolΩ w funkcjonowaniu kom≤rki tworz▒c ╢rodowisko dla reakcji chemicznych i oddzia│ywa± miΩdzykom≤rkowych.
Woda posiada specyficzne cechy wyr≤┐niaj▒ce j▒ spo╢r≤d innych zwi▒zk≤w chemicznych i czyni▒ce niezbΩdn▒ dla istnienia ┐ycia.
Cz▒steczka wody sk│ada siΩ z atomu tlenu i dw≤ch atom≤w wodoru. Nie s▒ one u│o┐one liniowo, lecz tworz▒ tr≤jk▒t.
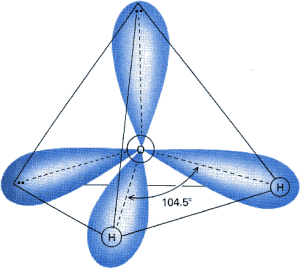
Takie u│o┐enie atom≤w determinuje jedn▒ z najistotniejszych cech cz▒steczki wody û polarno╢µ. Atomy wodoru po│▒czone s▒ z tlenem wi▒zaniami kowalencyjnymi. Du┐a r≤┐nica elektroujemno╢ci pomiΩdzy tymi pierwiastkami (tlen 3,5; wod≤r 2,1) powoduje przesuniΩcie elektron≤w od atom≤w wodoru w kierunku tlenu. Na wodorze powstaje niewielki │adunek dodatni (d +), natomiast po przeciwnej stronie atomu tlenu, na wyimaginowanym wierzcho│ku tetraedru tworzonego przez atomy, pojawia siΩ │adunek ujemny (d û). W wyniku tego cz▒steczka wody jest dipolem: pomimo, ┐e jako ca│o╢µ ma │adunek obojΩtny, jej elektrony rozmieszczone s▒ niesymetrycznie, co czyni j▒ spolaryzowan▒.
Wynikiem polaryzacji cz▒steczek H2O jest tworzenie przez nie wi▒za± wodorowych.
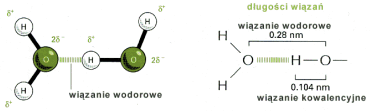
Wp│ywaj▒ one w zasadniczy spos≤b na strukturΩ i w│a╢ciwo╢ci wody. Pojedyncza cz▒steczka │▒czyµ siΩ mo┐e z czterema innymi znajduj▒cymi siΩ w pobli┐u tworz▒c nietrwa│▒ sieµ.
Im ni┐sza temperatura wody, tym wiΩcej pojawia siΩ takich struktur sieciowych. Jednak nawet w 37░ C oko│o 15% cz▒steczek H2O pozostaje zwi▒zanych. Ta specyficzna dla wody w│a╢ciwo╢µ odpowiada za cechy takie jak wysokie napiΩcie powierzchniowe wody, du┐e ciep│o w│a╢ciwe i niska temperatura zamarzania. W│asno╢ci te maj▒ zasadnicze znaczenie dla istnienia ┐ycia û miΩdzy innymi powoduj▒, ┐e w warunkach fizycznych panuj▒cych na Ziemi woda wystΩpuje w stanie ciek│ym.
Kolejn▒ cech▒ wynikaj▒c▒ z polarnego charakteru cz▒steczek H2O jest ich zdolno╢µ do otaczania jon≤w i innych cz▒steczek polarnych. Wynika to z przyci▒gania siΩ │adunk≤w r≤┐noimiennych: jony posiadaj▒ okre╢lony │adunek dodatni (kationy) lub ujemny (aniony), a cz▒steczki polarne wykazuj▒ nier≤wnomierne roz│o┐enie r≤wnowa┐▒cych siΩ │adunk≤w na swojej powierzchni. Moleku│a wody ustawia siΩ w taki spos≤b, aby dostosowaµ siΩ │adunkiem do cz▒steczki, z kt≤r▒ oddzia│uje:
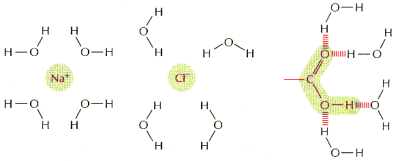
Te cz▒steczki, kt≤re dziΩki swojemu │adunkowi dobrze wbudowuj▒ siΩ w usieciowan▒ strukturΩ wody nazywamy hydrofilowymi. Wykazuj▒ one dobr▒ rozpuszczalno╢µ w roztworach wodnych.
Moleku│y niepolarne i nie posiadaj▒ce okre╢lonego │adunku zak│≤caj▒ tr≤jwymiarow▒ strukturΩ wody utworzon▒ przez wi▒zania wodorowe.
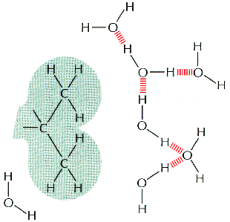
Cz▒steczki takie, nie wi▒┐▒c siΩ z moleku│ami H2O s▒ wypychane poza sieµ. Skupiaj▒ siΩ one w grupy i uk│adaj▒ tak, aby powierzchnia kontaktu z wod▒ by│a jak najmniejsza. Cz▒steczki takie nazywa siΩ hydrofobowymi; s▒ one s│abo rozpuszczalne w wodzie. Obecno╢µ takich moleku│ w ╢rodowisku wodnym powoduje tworzenie siΩ wok≤│ nich klatek û otoczek utworzonych z cz▒steczek H2O po│▒czonych wi▒zaniami wodorowymi. Stanowi▒ one struktury o wy┐szym stopniu organizacji czyli ni┐szej entropii. Poniewa┐ ka┐dy uk│ad d▒┐y do stanu o mo┐liwie najwy┐szej entropii, powstawanie ôklatekö jest niekorzystne energetycznie. Najlepszym rozwi▒zaniem jest skupienie hydrofobowych cz▒steczek tak, aby da│o siΩ je otoczyµ ôklatk▒ö o mo┐liwie najmniejszej powierzchni. To d▒┐enie do stanu optymalnego energetycznie jest si│▒ wywo│uj▒c▒ oddzia│ywa± hydrofobowych.
pH i stΩ┐enie jon≤w wodorowych
Woda ulega sta│ej, samoczynnej dysocjacji, w wyniku czego niewielka czΩ╢µ cz▒steczek znajduje siΩ zawsze w postaci jon≤w OHû- i H+.
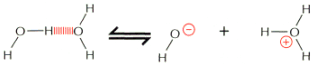
W trakcie dysocjacji pΩka jedno z wi▒za± OûH, a uwolniony kation H+ do│▒cza siΩ do cz▒steczki wody tworz▒c jon hydroniowy H3O+. Z tego powodu w roztworach wodnych praktycznie nie spotyka siΩ wolnych jon≤w H+. Jednak przy okre╢laniu stΩ┐enia jony podaje siΩ umownie jako [H+] i [OHû].
StΩ┐enie jon≤w wodorowych [H+] jest miar▒ kwasowo╢ci roztworu. W 25░ C w czystej wodzie stΩ┐enia wynosz▒: [H+]=[OHû]=10 û7 mola/litr. Dla uproszczenia przyjΩto u┐ywaµ skali pH, gdzie pH = ûlog10[H+].
| stΩ┐enie jonow wodorowych[mol/l] |
pH | przyk│ad | |
|---|---|---|---|
| odczyn kwasowy | 10-0 | 0 | |
| 10-1 | 1 | soki trawienne | |
| 10-2 | 2 | sok cytrynowy | |
| 10-3 | 3 | ocet winny | |
| 10-4 | 4 | kwa╢na gleba | |
| 10-5 | 5 | lizozomy | |
| 10-6 | 6 | cytoplazma skurczonych miΩ╢ni | |
| odczyn obojΩtny | 10-7 | 7 | czysta woda i cytoplazma |
| odczyn zasadowy | 10-8 | 8 | woda morska |
| 10-9 | 9 | zasadowa gleba | |
| 10-10 | 10 | jeziora o odczynie zasadowym | |
| 10-11 | 11 | woda amoniakalna | |
| 10-12 | 12 | ||
| 10-13 | 13 | ||
| 10-14 | 14 |
W powy┐szych warunkach pH=7. Roztw≤r o takim odczynie okre╢la siΩ jako obojΩtny.
Zgodnie z teori▒ Br÷nsteda-LowryÆego kwasem nazywamy cz▒steczkΩ, kt≤ra w roztworze uwalnia jon H+ (donor wodoru), zasad▒ natomiast tak▒, kt≤ra go przy│▒cza (akceptor wodoru):
kwas ≤ H+ + zasada
Przyk│adem kwasu mo┐e byµ HCl, kt≤ry dysocjuje w roztworze wodnym na H+ i Clû:
HCl≤ H+ + Clû
Zasad▒ jest na przyk│ad CH3ûNH2, kt≤ry w roztworze przy│▒czy H+:
CH3ûNH2 + H+≤CH3ûNH3+
Gdy do roztworu dodaje siΩ kwasu, uwalniane s▒ protony i wzrasta [H+], a tym samym spada [OHû], kt≤ry │▒czy siΩ z jonami H+. Zgodnie ze wzorem, wraz ze wzrostem [H+] spada warto╢µ pH.
Utrzymanie w│a╢ciwego pH jest niezbΩdne dla funkcjonowania licznych mechanizm≤w kom≤rkowych. Zale┐y od niego miΩdzy innymi sfa│dowanie bia│ek, a co za tym idzie, w│a╢ciwe dzia│anie enzym≤w. Ekstremalne pH doprowadziµ mog▒ do denaturacji bia│ka. Ka┐dy enzym posiada optymalne dla swojego funkcjonowania pH.
Zar≤wno w organizmie, jak i w warunkach in vitro spotyka siΩ bufory. S▒ to roztwory zawieraj▒ce sprzΩ┐on▒ parΩ kwas-zasada, pomiedzy kt≤rymi mo┐e mieµ miejsce przep│yw jon≤w wodorowych. DziΩki temu bufor niweluje wahania [H+] i opiera siΩ niewielkim zmianom pH. Przyk│adem buforu mo┐e byµ para kwas octowy-jon octanowy. W przypadku zmiany stΩ┐enia jon≤w H+ lub OHû s▒ one wychwytywane odpowiednio przez jon octanowy lub kwas octowy. Zapobiega to pojawianiu siΩ w roztworze nadmiaru tych jon≤w. Oczywi╢cie bufor dzia│a tylko w pewnym zakresie stΩ┐e± jon≤w û p≤╝niej jego sk│adniki ulegaj▒ wysyceniu i traci on swoje zdolno╢ci.
Uk│ady buforuj▒ce zabezpieczaj▒ struktury i mechanizmy kom≤rkowe przed wahaniami pH amortyzuj▒c niemal ca│kowicie jego zmiany.

⌐ 1997, 1998 Biologia Molekularna w Internecie Webmaster







