Zwi▒zki nieorganiczne
TlenkiTlenek azotu(IV) NO2 Dwutlenek azotu; czerwonobrunatny, silnie truj▒cy gaz o charakterystycznym zapachu. Jest paramagnetyczny, gdy┐ zawiera niesparowany elektron. NO2 │atwo oddaje sw≤j niesparowany elektron tworz▒c kation nitrylowy, NO2+. Jest on izoelektronowy z CO2 i ma budowΩ liniow▒. Tlenek azotu(IV) podczas och│adzania poni┐ej temp. wrzenia 22,4oC skrapla siΩ na ciecz, kt≤ra staje siΩ coraz ja╢niejsza, w ko±cu bezbarwna i zestala siΩ w temp. -10,2oC, tworz▒c bezbarwne kryszta│y. Zmiana barwy jest spowodowana reakcj▒ dimeryzacji: 2NO2 (brunatny)
(bezbarwny). W wy┐szej temp. r≤wnowaga tej reakcji przesuwa siΩ w kierunku powstawania NO2; w temp. 27oC 80% jest w postaci N2O4, w temp. 100oC N2O4 stanowi 10%. Tlenek azotu (IV) w temp. 200oC zaczyna siΩ rozk│adaµ na tlenek azotu(II) i tlen: 2NO2 palenie (np. potasu, fosforu, wΩgla, siarki). Dimer tlenku azotu(IV) - czterotlenek dwuazotu jest bezwodnikiem kwasowym; z wod▒ tworzy kwasy azotowy(III) i azotowy(V) N2O4 + H2O N2O4 w odr≤┐nieniu od NO2 jest diamagnetyczny. Otrzymywany przez utlenianie tlenku azotu(II) w niezbyt wysokiej temp. 2NO + O2 przemys│owa; otrzymany NO2 jest p≤│produktem do wytwarzania kwasu azotowego), przez redukcjΩ kwasu azotowego metalami, np. Cu + 4HNO3 azotan≤w metali ciΩ┐kich, np. Pb(NO3)2 jako ╢rodek nitruj▒cy, utleniaj▒cy, katalizator, utleniacz paliw rakietowych, itd. Tlenek krzemu SiO2 Dwutlenek krzemu, krzemionka; substancja sta│a wystΩpuj▒ca w trzech odmianach polimorficznych: kwarc (uk│ad heksagonalny, d=2,66), trydymit (uk│ad heksagonalny, d=2,30), krystobalit (uk│ad regularny, d=2,27). Ka┐da z tych odmian posiada odmianΩ niskotemperaturow▒ ( przebiegaj▒ w nastΩpuj▒cych temp.:
Przej╢cia miΩdzy odmianami bardzo szybko, natomiast pozosta│e przemiany (pomiΩdzy odmianami DziΩki temu trydymit i krystobalit mog▒ istnieµ w niskich temp. jako odmiany metastabilne. Pod bardzo wysokimi ci╢nieniami otrzymano inne odmiany polimorficzne SiO2: keatyt, coezyt i stiszofit. Kwarc
aktywno╢µ optyczn▒, maj▒ ponadto w│asno╢ci piezoelektryczne. Kryszta│y kwarcu, trydymitu i krystobalitu s▒ zbudowane z tetraedr≤w SiO4 po│▒czonych w ten spos≤b, ┐e ka┐dy atom tlenu jest wsp≤lny dla dw≤ch tetraedr≤w. W krystobalicie atomy Si s▒ rozmieszczone tak, ┐e w ╢rodku odleg│o╢ci miΩdzy nimi znajduj▒ siΩ atomy tlenu. W kwarcu i trydymicie tetraedry SiO4 tworz▒ uk│ad spiralny. Dwutlenek krzemu topi siΩ w temp. 1710oC. Nawet podczas b. wolnego och│adzania zestala siΩ na szkliste, bezpostaciowe cia│o sta│e (szk│o kwarcowe), odporne na dzia│anie czynnik≤w chemicznych z wyj▒tkiem fluorowodoru i alkali≤w. Szk│o kwarcowe ma ma│y wsp≤│czynnik rozszerzalno╢ci termicznej, dziΩki czemu wykazuje du┐▒ odporno╢µ na szybkie zmiany temp. Dobrze przepuszcza promienie nadfioletowe. Dwutlenek krzemu reaguje na zimno z fluorowodorem SiO2 + 4HF mocne reduktory redukuj▒ SiO2 do wolnego krzemu. W temp. 1400oC w pr≤┐ni SiO2 reaguje z krzemem tworz▒c lotny tlenek krzemu SiO, kt≤ry po och│odzeniu ulega rozk│adowi na substraty. Dwutlenek krzemu nie wchodzi w reakcjΩ z wod▒, jednak jest tlenkiem kwasowym poniewa┐ podczas stapiania lub d│u┐szego gotowania w stΩ┐onych roztworach reaguje z wodorotlenkami i wΩglanami litowc≤w, tworz▒c rozpuszczalne w wodzie krzemiany, np. SiO2 + 2NaOH Dodanie mocnego kwasu, np. HCl do roztworu krzemian≤w litowc≤w powoduje powstanie produkt≤w o trudnym do zdefiniowania sk│adzie (kwasy krzemowe). S▒ to pocz▒tkowo zole, a nastΩpnie ┐ele, w kt≤rych na 1 cz▒steczkΩ SiO2 mo┐e przypadaµ do 330 cz▒steczek H2O. Po usuniΩciu z roztworu resztek soli i odwodnieniu do zawarto╢ci wody oko│o 4%, otrzymuje siΩ tward▒, ziarnist▒ substancjΩ, kt≤ra mo┐e poch│aniaµ wodΩ w spos≤b odwracalny (tzw. silika┐el lub ┐el krzemionkowy). Silika┐el jest stosowany jako ╢rodek susz▒cy, katalizator, no╢nik katalizator≤w (np. V2O5). Dwutlenek krzemu wystepuje w przyrodzie w du┐ych ilo╢ciach jako piasek. Jest ko±cowym produktem produktem bardzo powolnego rozk│adu krzemian≤w pod wp│ywem wody i dwutlenku wΩgla. Piasek zawiera najczΩ╢ciej r≤┐ne zanieczyszczenia, prawie czyst▒ krzemionk▒ jest piasek morski. W przyrodzie wystΩpuj▒ wszystkie trzy odmiany polimorficzne SiO2 w postaci czystej lub z niewielkimi domieszkami, np. kwarc jako ametyst lub kwarc przydymiony. Drobnoziarnisty kwarc jest g│≤wnym sk│adnikiem wielu minera│≤w, m.in. opalu, chalcedonu i agatu. Dwutlenek krzemu (piasek) jest stosowany do produkcji szk│a, szk│a wodnego, zaprawy murarskiej, cementu, wyrob≤w ceramicznych, emalii, form odlewniczych i innych. Jest r≤wnie┐ surowcem do otrzymywania krzemu i jego stop≤w. Kwarc jest stosowany do wyrobu pryzmat≤w i soczewek w przyrz▒dach optycznych. Piezoelektryczne w│asno╢ci kwarcu wykorzystuje siΩ m.in. w radiotechnice. Tlenek siarki(IV) SO2 Dwutlenek siarki; jest bezbarwnym gazem o ostrym, dusz▒cym zapachu, dzia│a dra┐ni▒co na drogi oddechowe. W temp. -10oC ulega skropleniu na bezbarwn▒ ciecz, zestala siΩ w temp. -72,5oC tworz▒c bia│e kryszta│y. Temperatura krytyczna wynosi 157,2oC. Rozpuszcza siΩ w wodzie (4 objΩto╢ci w 10 objΩto╢ciach H2O w temp. 20oC), acetonie i kwasie octowym. Z roztworu wodnego w temp. 0oC krystalizuje hydrat SO2*H2O, trwa│y do temp. 12oC. Cz▒steczka SO2 ma budowΩ k▒tow▒; moment dipolowy wynosi 1,60D. Tlenek siarki(IV) jest tlenkiem kwasowym, reaguje z wod▒ tworz▒c kwas siarkowy(IV): SO2 + H2O
Podczas rozpuszczania SO2 w roztworach wodorotlenk≤w litowc≤w powstaj▒ siarczany(IV) lub wodorosiarczany SO2 + 2NaOH SO2 + NaOH redukuj▒ce jak i utleniaj▒ce. W kwa╢nym ╢rodowisku redukuje manganiany do zwi▒zk≤w manganu(II), dwuchromiany do chromu(III), ┐elazo(III) do ┐elaza(II). W stosunku do silnych czynnik≤w redukuj▒cych przejawia w│asno╢ci utleniaj▒ce, np. w reakcji z wilgotnym siarkowodorem 2H2S + SO2 przymys│ow▒ ten proces jest stosowany do produkcji kwasu siarkowego. Tlenek siarki(IV) skrapla siΩ na bezbarwn▒ ciecz nie przewodz▒c▒ pr▒du elektrycznego, lecz rozpuszczone w nim elektrolity, np. NaCl, ulegaj▒ dysocjacji elektrolitycznej, poniewa┐ przenikalno╢µ elektryczna ciek│ego SO2 ma do╢µ du┐▒ warto╢µ (13,2). Autodysocjacja ciek│ego SO2 przebiega wed│ug r≤wnania 2SO2 jest otrzymywany przez pra┐enie pirytu (FeS2) lub siarczk≤w metali w obecno╢ci powietrza; 4FeS2 + 11O2 przez spalanie siarki lub siarkowodoru S + O2 W laboratorium jest otrzymywany przez dzia│anie stΩ┐onym kwasem siarkowym na mied╝ Cu + H2SO4 Na2SO3 + 2HClaq produkcji kwasu siarkowego, pozatym znajduje zastosowanie do wybielania w│≤kien, papieru, we│ny i s│omy, jako ╢rodek owadob≤jczy oraz jako konserwant win i sok≤w owocowych (symbol E 220). Tlenek wapnia CaO Wapno palone; bia│y, higroskopijny proszek, temp. topnienia 2576oC, reaguje gwa│townie z wod▒ CaO + H2O otrzymywany przez pra┐enie kamienia wapiennego w temp. 900-1000oC CaCO3 Stosowany do wyrobu zaprawy murarskiej (jej twardnienie polega m.in. na reakcji Ca(OH)2 + CO2 wyrobu karbidu, w metalurgii jako dodatek szlakuj▒cy, w rolnictwie jako ╢rodek zmniejszaj▒cy zakwaszenie gleby, w cukrownictwie (defekacja), w garbarstwie do odw│osiania sk≤r, a tak┐e do oczyszczania gaz≤w do zmydlania t│uszcz≤w podczas produkcji stearyny i do wyrobu farb wapiennych. Tlenek wΩgla(IV) CO2 Dwutlenek wΩgla w przygotowaniu. Woda H2O Tlenek wodoru w przygotowaniu. WodorkiAmoniak NH3 Azan; bezbarwny gaz o przenikliwym zapachu, temp. topnienia -77,7oC, temp. wrzenia -33,4oC, bardzo dobrze rozpuszczalny w wodzie (1142dm3 NH3 w 1dm3 H2O w temp. 0oC). W temp. wrzenia moment dipolowy amoniaku wynosi 1,48 D, a przenikalno╢µ elektryczna 22. W atmosferze powietrza lub tlenu amoniak spala siΩ (temp. zap│onu 780oC) ┐≤│tawym p│omieniem na azot i wodΩ. Podczas przepuszczania mieszaniny amoniaku z powietrzem (lub tlenem) przez roz┐arzon▒ siatkΩ platynow▒ powstaje tlenek azotu NO i woda 4NH3 + 5O2 otrzymywania kwasu azotowego). W podwy┐szonej temp. amoniak ma w│a╢ciwo╢ci redukuj▒ce. Redukuje m.in. tlenki niekt≤rych metali do wolnych metali, np.: 3CuO + 2NH3 2NH3aq + H2CO3 reakcja NH3 + H2O zatem amoniak jest do╢µ s│ab▒ zasad▒. Skroplony jest ciecz▒ zasocjowan▒ przez wi▒zania wodorowe. W ciek│ym NH3 rozpuszcza siΩ wiele zwi▒zk≤w; zar≤wno nieorganicznych, jak i organicznych. Dobrze rozpuszczaj▒ siΩ sole amonu oraz azotany i jodki, natomiast fluorki, chlorki, tlenki i wodorotlenki metali s▒ ╝le rozpuszczalne. Sole ulegaj▒ w amoniaku dysocjacji elektrolitycznej. Litowce i berylowce rozpuszczaj▒ siΩ w aminiaku bez wydzielenia wodoru, tworz▒c roztwory dobrze przewodz▒ce pr▒d elektryczny, np. s≤d tworzy ciemnoniebieski roztw≤r (br▒zowy przy wiΩkszych stΩ┐eniach sodu), z kt≤rego po pewnym czasie w obecno╢ci katalizatora wytr▒ca siΩ amidek sodu i wydziela siΩ wod≤r. Ze zwi▒zk≤w organicznych w NH3 rozpuszcaj▒ siΩ tylko te, kt≤re zawieraj▒ w cz▒steczkach atomy pierwiastk≤w silnie elektroujemnych, np.fenole, alkohole, estry, etery, amidy, zwi▒zki nitrowe. Nie rozpuszczaj▒ siΩ natomiast wΩglowodory, benzen rozpuszcza siΩ nieznacznie. ZastΩpuj▒c w amoniaku atomy wodoru atomami metali otrzymuje siΩ amidki, np.KNH2, imidki, np. BaNH, PbNH oraz azotki, np. Ca3N2. Znane s▒ r≤wnie┐ pochodne amoniaku zawieraj▒ce atomy fluorowc≤w, np. chloroamina NH2Cl, tr≤jjodek azotu NI3. Amoniak otrzymuje siΩpodczas bezposredniej syntezy z pierwiastk≤w 3H2 + N2 a w laboratorium - dzia│aj▒c NaOH na sole amonu. Amoniak jest stosowany do produkcji kwasu azotowego, sody metod▒ Solvaya, soli amonowych (stosowanych czΩsto jako nawozy sztuczne), mocznika, cyjanowodoru, w│≤kien sztucznych oraz jako czynnik ch│odz▒cy w urz▒dzeniach ch│odniczych. Hydrazyna N2H4 Hydrazyna w przygotowaniu. Siarkowod≤r H2S Suflan w przygotowaniu. WodorotlenkiWodorotlenek potasu KOH Pota┐ »r▒cy, Pota┐ Kaustyczny; w przygotowaniu. Wodorotlenek sodu NaOH Inne nazwy: soda kaustyczna, soda ┐r▒ca, zasada sodowa. Bia│e, higroskopijne cia│o sta│e, temp. topnienia 328oC, temp. wrzenia 1390oC, dobrze rozpuszczalny w wodzie (w temp.20oC 109g w 100cm3,w temp.100oC 342g w 100cm3) z wydzieleniem du┐ej ilo╢ci ciep│a; rozpuszczalny w alkoholu i glicerynie. Jest bardzo siln▒ zasad▒, poch│ania wilgoµ i dwutlenek wΩgla z powietrza, rozp│ywa siΩ i pokrywa kruch▒ skorup▒ wΩglanu sodu; wodne roztwory wodorotlenku sodu nazywano │ugiem sodowym. Otrzymywany jest przez elektrolizΩ wodnych roztwor≤w chlorku sodu g│≤wnie metod▒ elektorlizy przeponowej oraz elektrolizy rtΩciowej. U┐ywana jest r≤wnie┐ metoda kaustyfikacji sody (na sodΩ kalcynowan▒ dzia│a siΩ ╢wie┐ym wapnem gaszonym ): Ca(OH)2 + Na2CO3 wyrobu myd│a, rafinacji ropy naftowej, produkcji celulozy, barwnik≤w, detergent≤w, w przemy╢le w│≤kienniczym, do wyrobu szk│a wodnego, regeneracji kauczuku, jako odczynnik laboratoryjny. W postaci roztworu wodnego ( 10-30% ) jest sk│adnikiem r≤┐nych p│yn≤w czyszcz▒cych i wybielaczy (np.:Domestosu, Harpica, Cloroxu, i.t.p). Wodorotlenek wapnia Ca(OH)2 Wapno gaszone; bia│y proszek trudno rozpuszczalny w wodzie (w temp. 20oC 0,126g w 100cm3). Wodorotlenek wapnia jest mocn▒, a jednocze╢nie tani▒ zasad▒; jego roztw≤r wodny jest nazywany wod▒ wapienn▒. Zawiesina wodorotlenku wapnia w wodzie wapiennej nosi nazwΩ mleka wapiennego i jest stosowana jako bia│a farba. Otrzymuje siΩ go przez dzia│anie okre╢lon▒ ilo╢ci▒ wody na tlenek wapnia: CaO + H2O Wodorotlenek wapnia jest stosowany do wyrobu zaprawy murarskiej [powietrznej - tΩ┐ej▒cej pod wp│ywem dwutlenku wΩgla: Ca(OH)2 + CO2 cukrowniczym, do zmiΩkczania wody; Ca(OH)2 + Ca(HCO3)2 oraz do odzyskiwania amoniaku z roztwor≤w chlorku amonu w prcesie prdukcji sody. KwasyKwas azotowy (V) HNO3 Bezbarwna ciecz, temp. topnienia -41,1oC, temp. wrzenia 84oC, gΩsto╢µ 1,52 g/cm3, silnie dymi▒ca na wilgotnym powietrzu. WystΩpuje w znikomych ilo╢ciach w powietrzu (synteza tlenku azotu NO z pierwiastk≤w podczas wy│adowa± elektrycznych), sk▒d przechodzi do gleby, tworz▒c azotany. Miesza siΩ z wod▒ we wszystkich stosunkach, tworzy hydraty HNO3*H2O (temp. topnienia -38oC), HNO3*3H2O (temp. topnienia -18,5oC), z wod▒ tworzy azeotrop zawieraj▒cy 69,2% HNO3o temp. wrzenia 121,8oC i gΩsto╢ci 1,41 g/cm3 (postaµ handlowa, tzw.stΩ┐ont k.a.), rozk│ada siΩ powoli(czynnikiem przy╢pieszaj▒cym t▒ reakcjΩ jest ╢wiat│o) 4HNO3 rozrwory kwasu azotowego maj▒ zabarwienie ┐≤│te. Jest mocnym utleniaczem, substancje palne (np. drewno, s│oma, bibu│a) zapalaj▒ siΩ po zwil┐eniu stΩ┐.kwasem azotowym. Rozpuszcza wiΩkszo╢µ metali (z wyj▒tkiem metali szlachetnych np. Au, Pt) z wydzieleniem tlenk≤w azotu. Niekt≤re metale (np. Al, Cr, Fe) ulegaj▒ pasywacji w stΩ┐onym k.a. podczas gdy roztwarzaj▒ siΩ w rozcie±czonym. Kwas azotowy utlenia niekt≤re niemetale (siarkΩ do kwasu siarkowego, fosfor do kwasu fosforowego). Zmieszany z kwasem siarkowym tworzy mieszaninΩ nitruj▒c▒, stosowan▒ do nitrowania zwi▒zk≤w organicznych. Mieszanina k.a. z kwasem solnym (w stosunku 1:3) nosi nazwΩ wody kr≤lewskiej. Woda kr≤lewska sw▒ wyj▒tkow▒ reaktywno╢µ zawdziΩcza wolnemu chlorowi i chlorokompleksom, tworz▒cym siΩ w niej: HNO3 + 3HCl by│ otrzymywany przez dzia│anie kwasem siarkowym na azotany, obecnie jest produkowany metod▒ katalitycznego utleniania amoniaku (metoda Ostwalda). Tlenek azotu powstaj▒cy w tej reakcji utlenia siΩ tlenem z powietrza 2NO + O2 NO2 + H2O barwnik≤w, ╢rodk≤w leczniczych, do nitrowania zwi▒zk≤w organicznych (m.in. przy produkcji matera│≤w wybuchowych), jako utleniacz w paliwach rakietowych. Kwas solny HCl aq Jest wodnym roztworem chlorowodoru. Inna nazwa: Kwas chlorowodorowy. Jest bardzo czynnym chemicznie, mocnym kwasem. Nasycony w temperaturze 15oC wodny roztw≤r kwasu solnego ma stΩ┐enie 42,7% i gΩsto╢µ 1,21g/cm3. W handlu znajduje siΩ oko│o 38% roztw≤r o gΩsto╢ci 1,19g/cm3. Rozpuszcza z wydzieleniem wodoru metale znajduj▒ce siΩ przed wodorem w szeregu napiΩciowym, np. Mg + 2HClaq Kwas chlorowodorowy znajduje siΩ w soku ┐o│▒dkowym (ok. 0,5%). Jest otrzymywany przez absorbcjΩ chlorowodoru w wodzie. Chlorowod≤r do produkcji kwasu solnego wytwarza siΩ syntetycznie z chloru i wodoru H2 + Cl2 gazy odpadowe z chlorowania zwi▒zk≤w organicznych, na przyk│ad syntezy Chlorku Benzylu: C6H6 + Cl2 na chlorek sodu H2SO4 + 2NaCl Stosowany w przemy╢le metalurgicznym, w│≤kienniczym, cukrowniczym, oraz do produkcji mas plastycznych, barwnik≤w organicznych i innych. Znajduje r≤wnierz zastosowanie w lecznictwie i jako jeden z podstawowych odczynnik≤w laboratoryjnych. Jest sk│adnikiem r≤┐nych ╢rodk≤w czyszcz▒cych np. Cilitu (oko│o 10% kwasu solnego) i innych. Kwas siarkowy (VI) H2SO4 Kwas siarkowy jest bezbarwn▒, ┐r▒c▒, oleist▒ ciecz▒; wrze w temp. 296oC, topi siΩ w temp. 10,36oC. Jest jednym z najwa┐niejszych produkt≤w stosowanych w przemy╢le chemicznym i innych (jest najta±szym mocnym kwasem), miesza siΩ z wod▒ we wszystkich stosunkach. StΩ┐ony kwas siarkowy jest silnie higroskopijny (dlatego jest stosowany jako ╢rodek susz▒cy i odci▒gaj▒cy wodΩ ), powoduje zwΩglanie substancji organicznych zawieraj▒cych tlen i wod≤r. StΩ┐ony kwas s. dzia│a utleniaj▒co, zw│aszcza w podwy┐szonej temp., rozpuszcza metale p≤│szlachetne np. Cu, Ag, z wydzieleniem dwutlenku siarki: Cu + 2H2SO4 kwasem dwuprotonowym. Metale znajduj▒ce siΩ w szeregu napiΩciowym przed wodorem rozpuszczaj▒ siΩ w rozcie±czonym kwasie siarkowym z wydzieleniem wodoru. Jako kwas trudno lotny k. siarkowy jest stosowany do wypierania kwas≤w lotniejszych np. HNO3, HCl, CH3COOH z ich soli np. NaCl + H2SO4 i wodorosiarczany. SO3 rozpuszcza siΩ w kwasie s. tworz▒c oleum czyli dymi▒cy kwas siarkowy, w kt≤rym wystΩpuj▒ kwasy polisiarkowe np. kwas dwusiarkowy(VI) H2S2O7. Dawniej by│ otrzymywany metod▒ komorow▒ (utlenianie SO2 do SO3 tlenkami azotu), obecnie jest otrzymywany metod▒ kontaktow▒ (utlenianie SO2 do SO3 tlenem z powietrza w obecno╢ci platyny lub tlenku wanadu(V) jako katalizatora). Stosowany w zale┐no╢ci od stΩ┐enia do: wyrobu rozpuszczalnych nawoz≤w fosforowych, siarczanu amonu i innych nawoz≤w sztucznych, do oczyszczania (trawiania) powierzchni metali (np. ┐elaza w celu usuniΩcia rdzy przed cynkowaniem, cynowaniem lub emaliowaniem), do suszenia gaz≤w, produkcji papieru, rafinacji t│uszcz≤w i olej≤w, do oczyszczania nafty i wosku ziemnego, do wyrobu w│≤kien sztucznych i materia│≤w wybuchowych, otrzymywania innych chemikali≤w, jako elektrolit w akumulatorach do sulfowania i nitrowania zwi▒zk≤w organicznych, w garbarstwie, dro┐d┐ownictwie, gorzelnictwie, farbiarstwie, itp. Postaµ handlowa: k.s. techniczny 76-78%, gΩsto╢µ 1,7g/cm3, k.s. techniczny stΩ┐ony 94-96%, gΩst.1,84g/cm3, k.s. czysty stΩ┐ony 95,6-98,8%, gΩst.1,84g/cm3, k.s. akumulatorowy ok. 30% H2SO4.Kwas fosforowy (V) H3PO4 Ortofosforowy(V) kwas, bia│e, krystaliczne cia│o sta│e, temp. topnienia 42,3oC, dobrze rozpuszczalny w wodzie (670g / 100g H2O w temp. 25oC). Jest kwasem tr≤jprotonowym o ╢redniej mocy (K1=1.1*10-2, K2=1.2*10-7, K3=1.8*10-12), tworzy trzy szeregi soli np. NaH2PO4, Na2HPO4, Na3PO4. W temp. pokojowej jest substancj▒ trwa│▒, nie ma w│asno╢ci utleniaj▒cych, podczas odwadniania ulega kondensacji tworz▒c kwasy polifosforowe. Jest otrzymywany w wyniku: 1)dzia│ania rozc. kwasem siarkowym na fosforan(V) wapnia (ew. apatyt lub zmielone ko╢ci) Ca3(PO4)2 + 3H2SO4 3)przez utlenianie fosforu czerwonego ╢rednio stΩ┐onym kwasem azotowym: 3P + 5HNO3 + 2H2O Stosowany g│≤wnie do wyrobu nawoz≤w sztucznych (superfosfat podw≤jny), do wyrobu fosforan≤w, w przemy╢le spo┐ywczym (jako dodatek do napoj≤w gazowanych [antyutleniacz] - symbol E 338), do wytwarzania fosforanowych pow│ok ochronnych na metalach, do wytwarzania wielu ╢rodk≤w farmaceutycznych. Kwas fosforowy jest r≤wnie┐ u┐ywany do oczyszczania sok≤w w cukrownictwie, jako p│yn do lutowania, w stomatologii, do wyrobu kit≤w porcelanowych, w lecznictwie i laboratoriach analitycznych. Kwas borowy H3BO3 Ortoborowy Kwas w przygotowaniu. Kwas chlorowy (V) HClO3 Kwas chlorowy w przygotowaniu. Kwas chlorowy (VII) HClO4 Kwas nadchlorowy w przygotowaniu. Azotany (V)Azotan (V) baru Ba(NO3)2 Azotan baru w przygotowaniu. Azotan (V) potasu KNO3 Saletra Indyjska, Saletra Potasowa; bia│a krystaliczna substancja, temp. topnienia 339oC, w wy┐szej nastΩpuje rozk│ad 2KNO3 w temp. 100oC 246 g/100 cm3). Otrzymywany w reakcji wymiany miΩdzy chlorkiem potasu i azotanem sodu KCl + NaNO3 chilijska. Dawniej wydobywano j▒ w znacznych ilo╢ciach w Indiach. Stosowana jako naw≤z sztuczny, do wyrobu prochu strzelniczego, do otrzymywania azotanu (III) potasu (potrzebnego do wyrobu barwnik≤w azowych), do konserwowania miΩsa (dodatek o symbolu E 252) itd. Azotan (V) sodu NaNO3 Saletra Chilijska; w przygotowaniu. Stosowany jako konserwant ┐ywno╢ci - symbol E 251. Azotan (V) wapnia Ca(NO3)2 Saletra norweska w przygotowaniu. BoranyTetraboran sodu Na2B4O7 Boraks w przygotowaniu. BromkiBromek potasu KBr Bromek potasu w przygotowaniu. Chlorany (V)Chloran (V) potasu KClO3 Chloran potasu w przygotowaniu. Chlorany (VII)Chloran (VII) potasu KClO4 Nadchloran potasu w przygotowaniu. ChlorkiChlorek amonu NH4Cl Salmiak w przygotowaniu. Chlorek baru BaCl2 Chlorek baru w przygotowaniu. Chlorek fosforu (V) PCl5 Chlorek fosforu w przygotowaniu. Chlorek glinu AlCl3 Chlorek glinu w przygotowaniu. Chlorek magnezu MgCl2 Chlorek magnezu w przygotowaniu. Chlorek potasu KCl Chlorek potasu w przygotowaniu. Chlorek rtΩci (II) HgCl2 Chlorek rtΩci w przygotowaniu. Chlorek sodu NaCl S≤l kuchenna; bezbarwna substancja krystaliczna, temp.topnienia 801oC, temp.wrzenia 1413oC, w stanie czystym nie jest higroskopijny, jego rozpuszczalno╢µ w wodzie (w temp.20oC 35,8g w 100cm3) w bardzo niewielkim stopniu zale┐y od temperatury. WystΩpuje w wodzie morskiej (ok.2,7%), w postaci do╢µ rozpowszechnionych z│≤┐ soli kamiennej (halitu) np. w Polsce, Argentynie, Chinach, by│ym ZSRR. S≤l kamienn▒ wydobywa siΩ zwyk│ymi metodami g≤rniczymi i po zmieleniu oraz przesianiu stosuje siΩ j▒ do cel≤w przemys│owych lub wyp│ukuje ze z│o┐a otrzymuj▒c solankΩ. SolankΩ oczyszcza siΩ dodaj▒c wapna, wodorotlenku i wΩglanu sodu, a nastΩpnie odparowuje. S≤l z wody morskiej otrzymuje siΩ przez odparowanie z wykorzystaniem energii s│onecznej. Z Chlorku sodu otrzymuje siΩ metaliczny s≤d, wΩglan sodu, wodorotlenek sodu, kwas solny i chlor. Stosowany do cel≤w spo┐ywczych i jako ╢rodek konserwuj▒cy, w przemy╢le barwnikarskim i garbarskim oraz do wysalania zwi▒zk≤w organicznych. Chlorek sodu zmieszany z lodem jest stosowany jako mieszanina oziΩbiaj▒ca (do temp. -21oC). W lecznictwie jest u┐ywany fizjologiczny roztw≤r soli - 0,9% roztw≤r NaCl, izotoniczny z p│ynami ustrojowymi. Chlorek srebra AgCl Chlorek srebra w przygotowaniu. Chlorek ┐elaza (II) FeCl2 Chlorek ┐elazawy w przygotowaniu. Chlorek ┐elaza (III) FeCl3 Chlorek ┐elazowy w przygotowaniu. Chromiany (VI)Chromian potasu K2CrO4 Chromian Potasu w przygotowaniu. Dwuchromian potasu K2Cr2O7 Dwuchromian Potasu w przygotowaniu. CyjankiCyjanek potasu KCN Cyjanek potasu w przygotowaniu. Fosforany (V)Fosforan (V) sodu Na3PO4 Fosforan sodu w przygotowaniu. KrzemianyMetakrzemian sodu Na2SiO3 Szk│o wodne; w przygotowaniu. Manganiany (VII)Manganian (VII) potasu KMnO4 Nadmanganian Potasu w przygotowaniu. Siarczany (IV)Siarczan (IV) sodu Na2SO3 Siarczyn sodu w przygotowaniu. Siarczany (VI)Siarczan (VI) baru BaSO4 Biel barowa; bezbarwna substancja krystaliczna lub ╢nie┐nobia│y proszek (zale┐y od stopnia rozdrobnienia). Topi siΩ w temp. 1580oC, jest praktycznie nierozpuszczalny w wodzie, nie truj▒cy (w odr≤┐nieniu od innych zwi▒zk≤w baru), odporny na dzia│anie siarkowodoru, czynnik≤w atmosferycznych i chemicznych, rozpuszcza siΩ w stΩ┐onym kwasie siarkowym. WystΩpuje w przyrodzie jeko minera│ baryt (szpat cziΩ┐ki). Do cel≤w technicznych otrzymywany przez mielenie naturalnego minera│u barytu na sucho lub mokro albo z chlorku baru przez dzia│anie siarczanem (VI) sodu:
BaCl2 + Na2SO4 produkcji farb, ╢rodek obci▒┐aj▒cy w produkcji papieru (papier fotograficzny), wype│niacz kauczuku i tworzyw sztucznych, w lecznictwie jako substancja kontrastowa w prze╢wietleniach przewodu pokarmowego oraz w kosmetyce do wyrobu pudr≤w. Siarczan (IV) glinu Al2(SO4)3 Siarczan glinu w przygotowaniu. Siarczan (VI) magnezu MgSO4 Epsomit, s≤l angielska, s≤l gorzka; bezbarwne kryszta│y, rozp. w wodzie (w temp. 20oC: 36,2g/100cm3); tworzy wiele hydrat≤w z kt≤rych najwa┐niejsze wystΩpuj▒ w przyrodzie: MgSO4*H2O (kizeryt) i MgSO4*7H2O oraz wiele soli podw≤jnych z siarczanami i chlorkami litowc≤w; np. kainit KCl*MgSO4*3H2O i szenit K2SO4*MgSO4*6H2O . WystΩpuje w wodzie morskiej i w wielu wodach mineralnych. Otrzymywany przez dzia│anie kwasem siarkowym na tlenek lub wΩglan magnezu. Stosowany w lecznictwie, garbarstwie, hutnictwie, jako zaprawa w przemy╢le farbiarskim, do obci▒┐ania bawe│ny, jedwabiu, papieru. Siarczan (VI) miedzi (II) CuSO4 Bia│a substancja sta│a, silnie higroskopijna, temp. topnienia 200oC, w temp. 650oC rozk│ada siΩ przechodz▒c w tlenek miedzi(II) CuO. Najbardziej znany jest w postaci 5* hydratu CuSO4*5H2O (koperwas, siny kamie±, chalkantyt) jako niebieskie, krystaliczne cia│o sta│e rozpuszczalne w wodzie i w metanolu. Otrzymywany przez rozpuszczenie miedzi w kwasie siarkowym Cu + 2H2SO4 farbiarstwie, jako substancja owadob≤jcza, do zwalczania chwast≤w, do wyrobu farb nieorganicznych, do barwienia mosi▒dzu na br▒zowo, wyrob≤w cynkowych, na brunatno, miedzi na czarno. Siarczan (IV) glinu K2SO4 Siarczan potasu w przygotowaniu. Siarczan (VI) sodu Na2SO4 Bia│e cia│o sta│e, temp. topnienia 884oC. Do╢µ dobrze rozpuszczalny w wodzie (48,8g/100cm3 w temp. 40oC), tworzy hydraty: Na2SO4*7H2O i Na2SO4*10H2O (s≤l galuberska). S≤l glauberska jest bezbarwnym cia│em sta│ym, rozp. w glicerynie, nierozpuszczalnym w alkoholu; topi siΩ we w│asnej wodzie krystalizacyjnej w temp. 32,4oC; otrzymywana przez krystalizacjΩ Na2SO4 w temp. ni┐szej ni┐ 32,4oC. Siarczan sodu jest otrzymywany przez dzia│anie kwasem siakowym na chlorek sodu w temp. 800oC 2NaCl + H2SO4 tenardyt na wybrze┐ach Morza Kaspijskkiego, w Kanadzie, w USA - w pok│adach, kt≤re nadaj▒ siΩ do eksploatacji. Znajduje zastosowanie w przemy╢le szklarskim, papierniczym i tekstylnym. TiosiarczanyTiosiarczan sodu Na2S2O3 Tiosiarczan sodu w przygotowaniu. WΩglanyWΩglan magnezu MgCO3 WΩglan magnezu w przygotowaniu. WΩglan sodu Na2CO3 Inne nazwy: soda, soda amoniakalna, soda kalcynowana. WΩgaln sodu jest bia│ym, krystalicznym, higroskopijnym proszkiem, topi▒cym siΩ w temp. 853oC. Jest rozpuszczalny w wodzie (w temp. 0oC 7,1g w 100cm3 , w temp. 100oC 45,5g w 100cm3), tworzy hydraty, z kt≤rych najwarzniejszy jest Na2CO3 * 10H2O (tzw. soda krystaliczna), roztwory wodne wskutek hydrolizy maj▒ odczyn silnie alkaliczny. W przyrodzie wystΩpuje w jeziorach sodowych (np. Owens Lake w Kalifornii, Magadi w Afryce Wschodniej) oraz w popio│ach ro╢lin morskich. WΩglan sodu jest otrzymywany przemys│owo metod▒ amoniakaln▒ Solvaya: Roztw≤r wodny chlorku sodu (solankΩ) nasyca siΩ amoniakiem, a nastΩpnie dwtlenkiem wΩgla: NaCl + H2O + NH3 + CO2 wodorowΩglan sodu, kt≤ry nastΩpnie jest poddawany pra┐eniu: 2NaHCO3 Powstaj▒cy CO2 kieruje siΩ z powrotem do procesu, amoniak odzyskuje siΩ dzia│aj▒c na roztw≤r chlorku amonu mlekiem wapiennym: 2NH4Cl + Ca(OH)2 Zastosowanie: do produkcji saletry sodowej, szk│a, celulozy, papieru, myd│a, ╢rodk≤w pior▒cych, w hutnictwie ┐elaza do odsiarczania oraz do zmiΩkczania wody. Zobacz r≤wnie┐ SodΩ oczyszczon▒. Jest dodawany do ┐ywno╢ci jako regulator kwasowo╢ci - symbol E 500a. WΩglan wapnia CaCO3 Kreda, Marmur; w przygotowaniu. Jest dodawany do past do zΩb≤w (pe│ni w nich rolΩ szoruj▒c▒) - symbol E 170. WodorowΩglanyWodorowΩglan sodu NaHCO3 Soda oczyszczona, soda do pieczenia, bikarbonat, kwa╢ny wΩglan sodu; w przygotowaniu. Jest dodawany do ┐ywno╢ci jako regulator kwasowo╢ci - symbol E 500b. Sole z│o┐oneHeksacyjano┐elazian (II) potasu K4[Fe(CN)6] »elazocyjanek potasu w przygotowaniu. Heksacyjano┐elazian (III) potasu K3[Fe(CN)6] »elazicyjanek potasu w przygotowaniu. Talk Mg3[(OH)2Si4O10] Stosowany jako wype│niacz wyrob≤w lakierowych oraz jako ╢rodek matuj▒cy. Jest sk│adnikiem farb podk│adowych oraz szpachl≤wek jako czynnik poprawiaj▒cy przyczepno╢µ. W przemy╢le gumowym stosowany do pudrowania mieszanek gumowych oraz p≤│fabrykat≤w tkaninowo-gumowych, w celu zabezpieczenia ich powierzchni przed zlepianiem siΩ podczas sk│adowania. Jako wype│niacz stosowany do mieszanek przeznaczonych do produkcji kabli elektrycznych, gumy kwasoodpornej, zabawek, powlekania tkanin i artyku│≤w gumowych stykaj▒cych siΩ z ┐ywno╢ci▒ i lekarstwami. WystΩpuje jako minera│ steatyt, twardo╢µ w skali Mohsa=1. Kr≤tka ankieta




 |
| Ostatnie zmiany wprowadzono: 24 sierpnia 1998 r. Wszelkie prawa zastrze┐one (c) 1998 Piotr Gogolewski | 
|



 N2O4
N2O4 . Stosowany
. Stosowany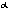 ) i wysokotemperaturow▒
(
) i wysokotemperaturow▒
(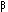 ). Przemiany fazowe SiO2
). Przemiany fazowe SiO2 + 2H2O
+ 2H2O Co s▒dzisz o mojej stronie ?
Co s▒dzisz o mojej stronie ?